据媒体报道,一项关于瑞德西韦的试验结果被意外披露在世界卫生组织(WHO)的网站上。根据研究总结,这项于中国开展的针对重症新冠感染患者的临床试验里,瑞德西韦用药组同对照组在临床改善时间上未有明显的差异。
针对此事,4月24日,吉利德全球首席医疗官MerdadParsey博士代表公司发布声明称:“这一信息已经被删除,因为研究人员并未许可公布结果。此外,我们认为那篇文章包含了对研究的不恰当描述。由于入组率低,该研究被提前终止,因此,它的数据不足以支撑有统计意义的结论。”
受此消息影响,4月23日,瑞德西韦生产商吉利德科学股价跳水,一度暂停交易,截至收盘时跌4.34%,较前一日市值蒸发44亿美元(约合310亿元人民币)。4月24日,国内瑞德西韦相关概念股也大幅收跌。
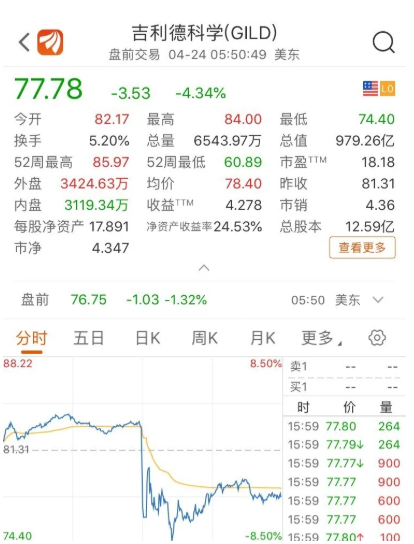
图片截自东方财富
一位行业人士向记者表示:“瑞德西韦在中国临床结果不乐观,也会降低其药物的市场前景。”
中国临床试验已经暂停
吉利德成立于1987年,多次融资后1992年公司在没有一款上市药品的情况下就在纳斯达克成功上市并募资8600万美元。公司最初业务主要以合作收入为主,1995年第一款药物Vistide上市后开始了其在抗病毒药物领域的发展。
让吉利德一战成名且被最为人熟知的是,公司借助HCV感染(丙型肝炎病毒)领域推行鸡尾酒疗法,以“吉一代”索非布韦为核心陆续推出了吉二代Harvoni、吉三代Epclusa和吉四代Vosevi,将丙肝的治愈率提升至接近100%,在HCV领域取得绝对的统治地位。
瑞德西韦(Redmdsivir)是吉利德研发的抗埃博拉病毒的试验药物,在此次新冠肺炎疫情中中也被给予厚望。
今年2月5日,中日友好医院王辰、曹彬团队在武汉市金银潭医院进开展瑞德西韦随机双盲试验,计划于4月27日结束。该测试主要评价药物的有效性和安全性。
据媒体报道,随着中国新冠肺炎疫情得到控制,瑞德西韦在中国进行的针对轻型、普通型COVID-19患者的临床研究因“入组率低”被暂停。在此之前,瑞德西韦在中国进行的针对重症COVID-19患者的临床试验由于入组率低而“暂停”,而最新状态已经更新为“终止”。
不过,4月11日,吉利德在《新英格兰医学》杂志上发布了瑞德西韦(Remdesivir)治疗新冠肺炎(COVID-19)的首个临床研究结果。结果显示,在53名来自美国、欧洲、加拿大及日本的严重和危重新冠肺炎患者中,瑞德西韦给68%(36人)的患者带来临床改善。
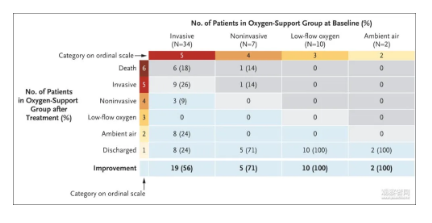
将公布更详细的信息
对于WHO发布此后又删除的消息,4月24日,吉利德表示,就其本身而言,该研究结果是非结论性的,尽管数据的趋势提示了瑞德西韦的潜在受益,尤其是在早期接受治疗的患者中。我们获悉现有的数据已经提交用于经同行评审的发布,近期将会看到这项研究的更详细的信息。
吉利德称,预期在本月底发布针对瑞德西韦用于新型冠状病毒肺炎重症患者的开放标签研究的结果。
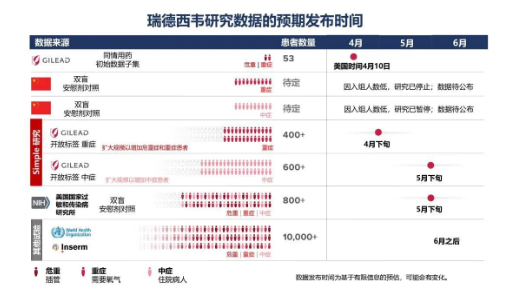
图片来源:吉利德科学公众号
据了解,这是一项随机的临床试验,已经完成全部的患者入组,研究将比较使用瑞德西韦5天或10天后的治疗结果和安全性。“我们预期在五月底获得对中症患者的开放标签研究数据,该研究将对比患者使用瑞德西韦5天、10天以及接受标准治疗的结果。我们预计,五月底还可以获得美国国家过敏和传染病研究所(NIAID)对不同严重程度的患者进行的瑞德西韦双盲、安慰剂对照研究的数据。”吉利德介绍。
 京公网安备 11010202007567号京ICP备17054264号
京公网安备 11010202007567号京ICP备17054264号

